پدیده ها و فرآیندهای طبیعی اطراف ما بسیار پیچیده هستند. برای توصیف فیزیکی دقیق آنها باید از یک دستگاه ریاضی دست و پا گیر استفاده کرد و تعداد زیادی از عوامل مهم را در نظر گرفت. برای جلوگیری از این مشکل، برخی از مدل های ساده شده در فیزیک استفاده می شود که تجزیه و تحلیل ریاضی فرآیند را تا حد زیادی تسهیل می کند، اما عملاً بر دقت توصیف آن تأثیر نمی گذارد. یکی از آنها مدل گاز ایده آل است. بیایید آن را با جزئیات بیشتری در مقاله در نظر بگیریم.
مفهوم یک گاز ایده آل
گاز ایده آل حالتی از تجمع یک ماده است که از نقاط مادی تشکیل شده است که با یکدیگر تعامل ندارند. اجازه دهید این تعریف را با جزئیات بیشتر توضیح دهیم.
اول، ما در مورد نقاط مادی به عنوان اجسامی صحبت می کنیم که یک گاز ایده آل را می سازند. این بدان معناست که مولکول ها و اتم های آن اندازه ندارند، بلکه جرم خاصی دارند. جسورانه استبا در نظر گرفتن این واقعیت که در همه گازهای واقعی در فشارهای پایین و دماهای بالا، فاصله بین مولکول ها بسیار بیشتر از ابعاد خطی آنهاست، می توان یک تقریب را در نظر گرفت.
ثانیاً، مولکول های یک گاز ایده آل نباید با یکدیگر تعامل داشته باشند. در واقع، چنین تعاملاتی همیشه وجود دارد. بنابراین، حتی اتم های گازهای نجیب جاذبه دوقطبی-دوقطبی را تجربه می کنند. به عبارت دیگر، تعاملات واندروالسی وجود دارد. با این حال، در مقایسه با انرژی جنبشی چرخش و حرکت انتقالی مولکول ها، این فعل و انفعالات آنقدر کوچک هستند که بر خواص گازها تأثیر نمی گذارند. بنابراین، آنها را نمی توان در حل مسائل عملی در نظر گرفت.
توجه به این نکته ضروری است که همه گازهایی که در آنها چگالی کم و دما زیاد است را نمی توان ایده آل در نظر گرفت. علاوه بر فعل و انفعالات واندروالس، انواع دیگر و قویتر پیوندها وجود دارد، به عنوان مثال، پیوندهای هیدروژنی بین مولکولهای H2O که منجر به نقض فاحش شرایط ایدهآل بودن گاز میشود. به همین دلیل، بخار آب یک گاز ایده آل نیست، اما هوا یک گاز ایده آل است.
مدل فیزیکی یک گاز ایده آل
این مدل را می توان به صورت زیر نشان داد: فرض کنید که سیستم گاز حاوی N ذره است. اینها می توانند اتم ها و مولکول های مواد شیمیایی و عناصر مختلف باشند. تعداد ذرات N زیاد است، بنابراین معمولاً از واحد "مول" برای توصیف آن استفاده می شود (1 مول با عدد آووگادرو مطابقت دارد). همه آنها در مقداری حجم V. حرکات ذرات حرکت می کنندآشفته و مستقل از یکدیگر هستند. هر کدام از آنها سرعت v خاصی دارند و در یک مسیر مستقیم حرکت می کنند.
از لحاظ نظری، احتمال برخورد بین ذرات تقریباً صفر است، زیرا اندازه آنها در مقایسه با فواصل بین ذرات کوچک است. با این حال، اگر چنین برخوردی رخ دهد، آنگاه کاملاً الاستیک است. در حالت دوم، تکانه کل ذرات و انرژی جنبشی آنها حفظ می شود.
مدل گازهای ایده آل در نظر گرفته شده یک سیستم کلاسیک با تعداد زیادی عنصر است. بنابراین سرعت و انرژی ذرات موجود در آن از توزیع آماری ماکسول بولتزمن تبعیت می کند. برخی از ذرات دارای سرعت پایین و برخی دیگر دارای سرعت بالایی هستند. در این مورد، محدودیت سرعت باریک مشخصی وجود دارد که محتمل ترین مقادیر این مقدار در آن قرار دارد. توزیع سرعت مولکول های نیتروژن به صورت شماتیک در زیر نشان داده شده است.
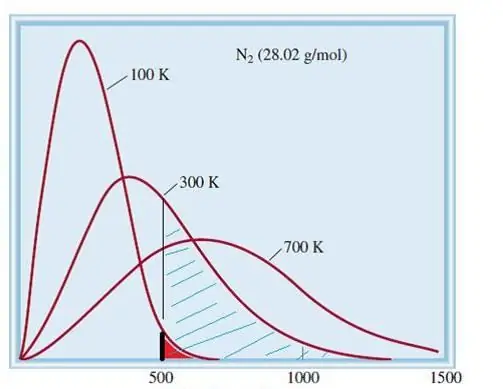
نظریه جنبشی گازها
مدل گازهای ایده آل که در بالا توضیح داده شد به طور منحصر به فردی خواص گازها را تعیین می کند. این مدل اولین بار توسط دانیل برنولی در سال 1738 ارائه شد.

متعاقباً توسط آگوست کرونیگ، رودولف کلازیوس، میخائیل لومونوسوف، جیمز ماکسول، لودویگ بولتزمن، ماریان اسمولوچوفسکی و دیگر دانشمندان به وضعیت کنونی خود توسعه یافت.
تئوری جنبشی مواد سیال، که بر اساس آن مدل گاز ایده آل ساخته شده است، دو ویژگی مهم ماکروسکوپی سیستم را بر اساس رفتار میکروسکوپی آن توضیح می دهد:
- فشار گازها نتیجه برخورد ذرات با دیواره ظرف است.
- دما در سیستم نتیجه تجلی حرکت ثابت مولکول ها و اتم ها است.
بیایید هر دو نتیجهگیری از نظریه جنبشی را گسترش دهیم.
فشار گاز
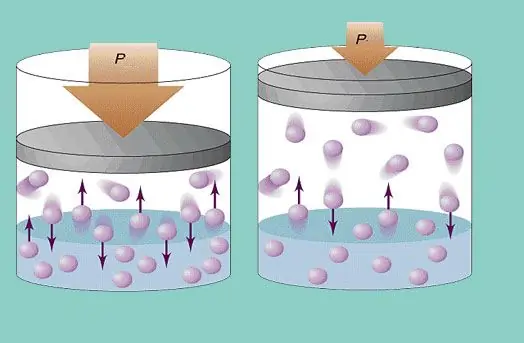
مدل گاز ایده آل یک حرکت آشفته ثابت ذرات در سیستم و برخورد مداوم آنها با دیواره های ظرف را فرض می کند. هر برخوردی کاملاً الاستیک در نظر گرفته می شود. جرم ذرات کوچک است (≈10-27-10-25 کیلوگرم). بنابراین در برخورد نمی تواند فشار زیادی ایجاد کند. با این وجود، تعداد ذرات و در نتیجه تعداد برخوردها بسیار زیاد است (≈1023). علاوه بر این، ریشه میانگین سرعت مربع عناصر در دمای اتاق چند صد متر در ثانیه است. همه اینها منجر به ایجاد فشار قابل توجهی بر روی دیواره کشتی می شود. با استفاده از فرمول زیر قابل محاسبه است:
P=Nmvcp2 / (3V)،
جایی که vcp ریشه میانگین سرعت مربع است، m جرم ذره است.
دمای مطلق
طبق مدل گاز ایده آل، دما به طور منحصر به فردی توسط میانگین انرژی جنبشی یک مولکول یا اتم در سیستم مورد مطالعه تعیین می شود. می توانید عبارت زیر را بنویسید که انرژی جنبشی و دمای مطلق را برای یک گاز ایده آل مرتبط می کند:
mvcp2 / 2=3 / 2kB T.
در اینجا kB ثابت بولتزمن است. از این برابری می گیریم:
T=m vcp2 / (3kB).
معادله جهانی حالت
اگر عبارات فوق را برای فشار مطلق P و دمای مطلق T ترکیب کنیم، می توانیم برابری زیر را بنویسیم:
PV=nRT.
در اینجا n مقدار ماده در مول است، R ثابت گازی است که توسط D. I. Mendeleev معرفی شده است. این عبارت مهمترین معادله در تئوری گازهای ایده آل است، زیرا سه پارامتر ترمودینامیکی (V, P, T) را ترکیب می کند و به ویژگی های شیمیایی سیستم گازی بستگی ندارد.

معادله جهانی برای اولین بار توسط فیزیکدان فرانسوی امیل کلاپیرون در قرن نوزدهم به صورت تجربی استخراج شد و سپس توسط شیمیدان روسی مندلیف به شکل امروزی خود آورده شد، به همین دلیل است که در حال حاضر نام این دانشمندان را بر خود دارد..






