مطالعه وضعیت سه بعدی آب مایع دشوار است، اما با تجزیه و تحلیل ساختار بلورهای یخ چیزهای زیادی آموخته شده است. چهار اتم اکسیژن همسایه که برهم کنش هیدروژن دارند، رئوس یک چهار وجهی را اشغال می کنند (تترا=چهار، هدرون=صفحه). میانگین انرژی لازم برای شکستن چنین پیوندی در یخ 23 کیلوژول بر مول-1 تخمین زده می شود.

توانایی مولکولهای آب برای تشکیل تعداد معینی زنجیره هیدروژنی، و همچنین قدرت معین، نقطه ذوب فوقالعاده بالایی ایجاد میکند. هنگامی که ذوب می شود توسط آب مایعی که ساختار آن نامنظم است نگه داشته می شود. بیشتر پیوندهای هیدروژنی تحریف شده اند. برای شکستن شبکه کریستالی یخ پیوند هیدروژنی مقدار زیادی انرژی به شکل گرما لازم است.
ویژگی های ظاهر یخ (Ih)
بسیاری از ساکنان از خود می پرسند که چه نوع یخ شبکه کریستالی دارد. ضروری استلازم به ذکر است که چگالی بیشتر مواد در هنگام انجماد افزایش می یابد، زمانی که حرکات مولکولی کند می شود و کریستال های متراکم تشکیل می شوند. چگالی آب نیز با سرد شدن به حداکثر در دمای 4 درجه سانتی گراد (277 کلوین) افزایش می یابد. سپس، وقتی دما به زیر این مقدار میرسد، منبسط میشود.
این افزایش به دلیل تشکیل یک کریستال یخ باز و پیوند هیدروژنی با شبکه و چگالی کمتر است که در آن هر مولکول آب به طور صلب با عنصر فوق و چهار مقدار دیگر محدود می شود، در حالی که به اندازه کافی سریع حرکت می کند. جرم بیشتری دارند از آنجایی که این عمل رخ می دهد، مایع از بالا به پایین منجمد می شود. این نتایج بیولوژیکی مهمی دارد، در نتیجه لایه یخ روی حوضچه موجودات زنده را از سرمای شدید عایق می کند. علاوه بر این، دو ویژگی اضافی آب به ویژگی های هیدروژن آن مربوط می شود: گرمای ویژه و تبخیر.
شرح تفصیلی سازه
معیار اول مقدار مورد نیاز برای افزایش دمای ۱ گرم از یک ماده به میزان ۱ درجه سانتی گراد است. افزایش درجات آب به مقدار نسبتاً زیادی گرما نیاز دارد زیرا هر مولکول درگیر پیوندهای هیدروژنی متعددی است که باید شکسته شوند تا انرژی جنبشی افزایش یابد. به هر حال، فراوانی H2O در سلولها و بافتهای همه موجودات چند سلولی بزرگ به این معنی است که نوسانات دما در داخل سلولها به حداقل میرسد. این ویژگی بسیار مهم است، زیرا سرعت اکثر واکنش های بیوشیمیایی استحساس.
گرمای تبخیر آب نیز به طور قابل توجهی بیشتر از گرمای بسیاری از مایعات دیگر است. برای تبدیل این جسم به گاز به مقدار زیادی گرما نیاز است زیرا پیوندهای هیدروژنی باید شکسته شود تا مولکول های آب از یکدیگر جدا شده و وارد فاز مذکور شوند. اجسام قابل تغییر دوقطبی های دائمی هستند و می توانند با سایر ترکیبات مشابه و آنهایی که یونیزه می شوند و حل می شوند، تعامل داشته باشند.
سایر مواد ذکر شده در بالا فقط در صورت وجود قطبیت می توانند در تماس باشند. این ترکیب است که در ساختار این عناصر نقش دارد. علاوه بر این، میتواند اطراف این ذرات تشکیلشده از الکترولیتها را همتراز کند، به طوری که اتمهای اکسیژن منفی مولکولهای آب به سمت کاتیونها، و یونهای مثبت و اتمهای هیدروژن به سمت آنیونها گرایش پیدا کنند.
در جامدات، به طور معمول، شبکه های کریستالی مولکولی و شبکه های اتمی تشکیل می شوند. یعنی اگر ید به گونه ای ساخته شده باشد که حاوی I2، باشد، در دی اکسید کربن جامد، یعنی در یخ خشک، مولکول های CO2 وجود دارد. واقع در گره های شبکه کریستالی . هنگام تعامل با مواد مشابه، یخ دارای یک شبکه کریستالی یونی است. برای مثال، گرافیت که ساختار اتمی مبتنی بر کربن دارد، مانند الماس قادر به تغییر آن نیست.
وقتی یک کریستال نمک خوراکی در آب حل می شود چه اتفاقی می افتد: مولکول های قطبی به سمت عناصر باردار در کریستال جذب می شوند که منجر به تشکیل ذرات مشابه سدیم و کلرید در سطح آن می شود و در نتیجه این اجسام ایجاد می شود.از یکدیگر جدا می شوند و شروع به حل شدن می کند. از اینجا می توان مشاهده کرد که یخ دارای یک شبکه کریستالی با پیوند یونی است. هر Na + محلول، انتهای منفی چندین مولکول آب را جذب می کند، در حالی که هر کلر محلول، انتهای مثبت را جذب می کند. پوسته ای که هر یون را احاطه کرده، کره فرار نامیده می شود و معمولاً حاوی چندین لایه از ذرات حلال است.
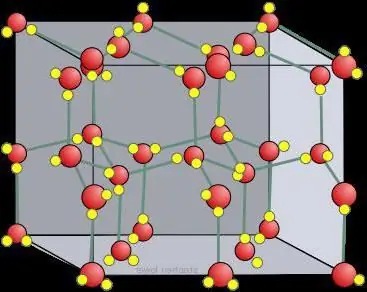
شبکه کریستال یخ خشک
متغیرها یا یک یون احاطه شده توسط عناصر سولفاته گفته می شود. هنگامی که حلال آب باشد، چنین ذرات هیدراته می شوند. بنابراین، هر مولکول قطبی تمایل دارد که توسط عناصر جسم مایع حل شود. در یخ خشک نوع شبکه کریستالی در حالت تجمع پیوندهای اتمی ایجاد می کند که بدون تغییر است. چیز دیگر یخ کریستالی (آب یخ زده) است. ترکیبات آلی یونی مانند کربوکسیلاز و آمین های پروتونه شده باید در گروه های هیدروکسیل و کربونیل محلول باشند. ذرات موجود در چنین ساختارهایی بین مولکول ها حرکت می کنند و سیستم های قطبی آنها با این جسم پیوند هیدروژنی تشکیل می دهند.
البته، تعداد آخرین گروه های نشان داده شده در یک مولکول بر حلالیت آن تأثیر می گذارد، که به واکنش ساختارهای مختلف در عنصر نیز بستگی دارد: به عنوان مثال، الکل های یک، دو و سه کربنه قابل امتزاج هستند. با آب، اما هیدروکربن های بزرگتر با ترکیبات تک هیدروکسیل در مایعات بسیار کمتر رقیق می شوند.
Ih شش ضلعی از نظر شکل مشابه استشبکه کریستال اتمی برای یخ و تمام برف های طبیعی روی زمین، دقیقاً شبیه این است. این با تقارن شبکه کریستالی یخ که از بخار آب (یعنی دانه های برف) رشد می کند، اثبات می شود. در گروه فضایی P 63/mm از 194 قرار دارد. D 6h، کلاس Laue 6/mm; شبیه β- که دارای مضرب 6 محور مارپیچ است (چرخش به اطراف علاوه بر جابجایی در طول آن). این یک ساختار نسبتاً باز با چگالی کم دارد که در آن راندمان پایین است (~1/3) در مقایسه با ساختارهای مکعبی ساده (~1/2) یا مکعب محور (~3/4) است.
در مقایسه با یخ معمولی، شبکه کریستالی یخ خشک، محدود به مولکول های CO2، ایستا است و تنها زمانی که اتم ها تجزیه می شوند تغییر می کند.
شرح توری ها و عناصر آنها
کریستالها را میتوان بهعنوان مدلهای کریستالی، متشکل از ورقهایی که روی هم قرار گرفتهاند، مشاهده کرد. پیوند هیدروژنی مرتب است، در حالی که در واقعیت تصادفی است، زیرا پروتون ها می توانند بین مولکول های آب (یخ) در دمای بالاتر از حدود 5 کلوین حرکت کنند. در واقع، این احتمال وجود دارد که پروتون ها مانند یک سیال کوانتومی در یک جریان تونل زنی ثابت رفتار کنند. این با پراکندگی نوترونها تقویت میشود و چگالی پراکندگی آنها را در نیمه راه بین اتمهای اکسیژن نشان میدهد که نشاندهنده محلیسازی و حرکت هماهنگ است. در اینجا شباهت یخ با یک شبکه کریستالی اتمی و مولکولی وجود دارد.
مولکولها دارای آرایش زنجیرهای هیدروژنی هستندبا توجه به سه همسایه خود در هواپیما. عنصر چهارم دارای آرایش پیوند هیدروژنی گرفتگی است. یک انحراف جزئی از تقارن شش ضلعی کامل وجود دارد، زیرا سلول واحد 0.3٪ در جهت این زنجیره کوتاهتر است. همه مولکول ها محیط های مولکولی یکسانی را تجربه می کنند. داخل هر "جعبه" فضای کافی برای نگهداری ذرات آب میان بافتی وجود دارد. اگرچه به طور کلی در نظر گرفته نشدهاند، اما اخیراً بهطور مؤثری توسط پراش نوترونی شبکه کریستالی پودری یخ شناسایی شدهاند.
تغییر مواد
بدنه شش ضلعی دارای سه نقطه با آب مایع و گاز 0.01 درجه سانتیگراد، 612 Pa، عناصر جامد - سه -21.985 درجه سانتیگراد، 209.9 مگاپاسکال، یازده و دو -199.8 درجه سانتیگراد، 70 MPa، و همچنین - 34.7 درجه سانتیگراد، 212.9 مگاپاسکال. ثابت دی الکتریک یخ شش ضلعی 97.5 است.
منحنی ذوب این عنصر با MPa داده می شود. معادلات حالت در دسترس هستند، علاوه بر آنها، برخی نابرابری های ساده مربوط به تغییر خواص فیزیکی به دمای یخ شش ضلعی و سوسپانسیون های آبی آن. سختی با درجه افزایش یا پایین تر از گچ (2≦) در 0 درجه سانتی گراد تا فلدسپات (6 موهس) در 80- درجه سانتی گراد، یک تغییر غیرعادی بزرگ در سختی مطلق (> 24 برابر) در نوسان است.
شبکه کریستالی شش ضلعی یخ صفحات و ستون های شش ضلعی را تشکیل می دهد، که در آن وجهه های بالایی و پایینی صفحات پایه هستند {0 0 0 1} با آنتالپی 5.57 میکروژول سانتی متر -2 ، و سایر اجزای جانبی معادل، قطعات منشور {1 0 -1 0} با 5، 94 نامیده می شوند.µJ cm -2. سطوح ثانویه {1 1 -2 0} با 6.90 MJ ˣ cm -2 را می توان در امتداد صفحات تشکیل شده توسط طرفین سازه ها تشکیل داد.
چنین ساختاری با افزایش فشار کاهش غیرعادی هدایت حرارتی را نشان می دهد (و همچنین یخ مکعبی و آمورف با چگالی کم)، اما با اکثر کریستال ها متفاوت است. این به دلیل تغییر پیوند هیدروژنی است که سرعت عرضی صوت را در شبکه کریستالی یخ و آب کاهش میدهد.
روش هایی وجود دارد که نحوه تهیه نمونه های کریستالی بزرگ و هر سطح یخی دلخواه را توضیح می دهد. فرض بر این است که پیوند هیدروژنی روی سطح جسم شش ضلعی مورد مطالعه نسبت به سیستم توده نظم بیشتری دارد. طیفسنجی متغیر با تولید فرکانس شبکه فازی نشان داده است که عدم تقارن ساختاری بین دو لایه بالایی (L1 و L2) در زنجیره HO زیرسطحی سطح پایه یخ ششضلعی وجود دارد. پیوندهای هیدروژنی پذیرفته شده در لایه های بالایی شش ضلعی ها (L1 O ··· HO L2) قوی تر از پیوندهای پذیرفته شده در لایه دوم به تجمع بالایی هستند (L1 OH ··· O L2). ساختارهای یخی شش ضلعی تعاملی موجود است.
ویژگی های توسعه
حداقل تعداد مولکولهای آب مورد نیاز برای تشکیل یخ تقریباً 25 ± 275 است، مانند یک خوشه ایکوسادرال کامل 280. تشکیل با سرعت 10 10 در رابط هوا و آب و نه در آب فله. رشد کریستال های یخ به نرخ رشد مختلف بستگی داردانرژی ها هنگام انجماد نمونه های بیولوژیکی، غذا و اندام ها، آب باید از یخ زدگی محافظت شود.
این معمولاً با سرعت خنکسازی سریع، استفاده از نمونههای کوچک و نگهدارنده سرما، و افزایش فشار برای هستهسازی یخ و جلوگیری از آسیب سلولی به دست میآید. انرژی آزاد یخ/مایع از ~30 mJ/m2 در فشار اتمسفر به 40 mJ/m-2 در 200 مگاپاسکال افزایش می یابد، که نشان می دهد دلیل ایجاد این اثر.
چه نوع شبکه کریستالی مشخصه یخ است
متناوبا، آنها می توانند سریعتر از سطوح منشوری (S2)، روی سطح تصادفی آشفته دریاچه های سریع یخ زده یا آشفته رشد کنند. رشد از وجه های {1 1 -2 0} حداقل یکسان است، اما آنها را به پایه های منشوری تبدیل می کند. داده های مربوط به توسعه کریستال یخ به طور کامل بررسی شده است. نرخ رشد نسبی عناصر چهره های مختلف به توانایی ایجاد درجه زیادی از هیدراتاسیون مفصل بستگی دارد. دمای (کم) آب اطراف، میزان انشعاب در کریستال یخ را تعیین می کند. رشد ذرات توسط سرعت انتشار در درجه پایینی از فوق خنکسازی، یعنی <2 درجه سانتیگراد، محدود میشود که منجر به تعداد بیشتری از آنها میشود.

اما توسط سینتیک های رشد در سطوح بالاتر افسردگی >4 درجه سانتیگراد محدود شده است که منجر به رشد سوزنی می شود. این شکل شبیه به ساختار یخ خشک (دارای یک شبکه کریستالی با ساختار شش ضلعی)، مختلف است.ویژگی های توسعه سطح و دمای آب اطراف (فوق سرد) که در پشت شکل های صاف دانه های برف قرار دارد.
تشکیل یخ در اتمسفر به شدت بر شکل گیری و خواص ابرها تأثیر می گذارد. فلدسپاتهایی که در گرد و غبار صحرا یافت میشوند و میلیونها تن در سال وارد جو میشوند، شکلدهندههای مهمی هستند. شبیهسازیهای رایانهای نشان دادهاند که این به دلیل هستهشدن صفحات کریستال یخ منشوری در صفحات سطحی پر انرژی است.
برخی عناصر و شبکه های دیگر
مواد محلول (به استثنای هلیوم و هیدروژن بسیار کوچک که می توانند وارد فضاهای میانی شوند) نمی توانند در ساختار Ih در فشار اتمسفر گنجانده شوند، بلکه به سطح یا لایه آمورف بین ذرات ذرات وارد می شوند. بدنه میکرو کریستالی برخی عناصر دیگر در محل های شبکه یخ خشک وجود دارد: یون های آشوبگر مانند NH4 + و Cl - که در انجماد مایع سبکتر از سایر موارد کیهانگردی مانند Na + و SO42-موجود است. ، بنابراین حذف آنها امکان پذیر نیست، زیرا آنها یک لایه نازک از مایع باقی مانده بین کریستال ها تشکیل می دهند. این می تواند منجر به شارژ الکتریکی سطح به دلیل تفکیک آب سطحی شود که بارهای باقی مانده را متعادل می کند (که می تواند منجر به تابش مغناطیسی نیز شود) و تغییر در pH لایه های مایع باقیمانده، به عنوان مثال NH 42SO4 اسیدیتر میشود و NaCl اساسیتر میشود.
بر وجه ها عمود هستندشبکه کریستالی یخ که لایه بعدی متصل شده را نشان می دهد (با اتم های O به رنگ سیاه). آنها با یک سطح پایه ای با رشد آهسته مشخص می شوند {0 0 0 1}، که در آن تنها مولکول های آب جدا شده متصل می شوند. یک سطح به سرعت در حال رشد {1 0 -1 0} از یک منشور که در آن جفت ذرات تازه متصل شده می توانند با هیدروژن با یکدیگر پیوند برقرار کنند (یک پیوند هیدروژنی / دو مولکول یک عنصر). سریعترین چهره در حال رشد {1 1 -2 0} (منشوری ثانویه) است، که در آن زنجیرههای ذرات تازه متصل شده میتوانند با پیوند هیدروژنی با یکدیگر تعامل داشته باشند. یکی از مولکولهای زنجیره/عنصر او شکلی است که برآمدگیهایی را تشکیل میدهد که تقسیم میشوند و تبدیل به دو طرف منشور را تشویق میکنند.
آنتروپی نقطه صفر
می تواند به عنوان S تعریف شود 0=k B ˣ Ln (N E0)، که در آن k B ثابت بولتزمن است، NE تعداد تنظیمات در انرژی E، و E0 کمترین انرژی است. این مقدار برای آنتروپی یخ شش ضلعی در صفر کلوین قانون سوم ترمودینامیک "آنتروپی یک کریستال ایده آل در صفر مطلق دقیقاً صفر است" را نقض نمی کند، زیرا این عناصر و ذرات ایده آل نیستند، پیوند هیدروژنی نامنظم دارند.
در این بدن، پیوند هیدروژنی تصادفی و به سرعت در حال تغییر است. این ساختارها دقیقاً از نظر انرژی برابر نیستند، اما به تعداد بسیار زیادی از حالتهای نزدیک انرژی گسترش مییابند که از «قوانین یخ» پیروی میکنند. آنتروپی نقطه صفر بی نظمی است که حتی اگر ماده تا حد مطلق خنک شود، باقی می ماندصفر (0 K=-273، 15 درجه سانتیگراد). ایجاد سردرگمی آزمایشی برای یخ شش ضلعی 3، 41 (0، 2) ˣ مول -1 ˣ K -1. از نظر تئوری، محاسبه آنتروپی صفر کریستال های یخ شناخته شده با دقت بسیار بیشتر (غفلت از نقص و گسترش سطح انرژی) نسبت به تعیین تجربی آن ممکن است.
دانشمندان و کار آنها در این زمینه
می تواند به عنوان S تعریف شود 0=k B ˣ Ln (N E0)، که در آن k B ثابت بولتزمن است، NE تعداد تنظیمات در انرژی E، و E0 کمترین انرژی است. این مقدار برای آنتروپی یخ شش ضلعی در صفر کلوین قانون سوم ترمودینامیک "آنتروپی یک کریستال ایده آل در صفر مطلق دقیقاً صفر است" را نقض نمی کند، زیرا این عناصر و ذرات ایده آل نیستند، پیوند هیدروژنی نامنظم دارند.
در این بدن، پیوند هیدروژنی تصادفی و به سرعت در حال تغییر است. این ساختارها دقیقاً از نظر انرژی برابر نیستند، اما به تعداد بسیار زیادی از حالتهای نزدیک انرژی گسترش مییابند که از «قوانین یخ» پیروی میکنند. آنتروپی نقطه صفر بی نظمی است که حتی اگر بتوان ماده را تا صفر مطلق خنک کرد (0=-273.15 درجه سانتیگراد) باقی می ماند. ایجاد سردرگمی آزمایشی برای یخ شش ضلعی 3، 41 (0، 2) ˣ مول -1 ˣ K -1. از نظر تئوری، محاسبه آنتروپی صفر کریستال های یخ شناخته شده با دقت بسیار بیشتر (غفلت از نقص و گسترش سطح انرژی) نسبت به تعیین تجربی آن ممکن است.

اگرچه ترتیب پروتون ها در یخ حجیم مرتب نشده است، سطح احتمالاً ترتیب این ذرات را به شکل نوارهایی از اتم های H-اتم آویزان و جفت های O-منفرد (آنتروپی صفر با پیوندهای هیدروژنی مرتب شده) ترجیح می دهد. اختلال نقطه صفر ZPE، J ˣ mol -1 ˣ K -1 و دیگران یافت می شود. با توجه به تمام موارد فوق، مشخص و قابل درک است که چه نوع شبکه های کریستالی مشخصه یخ هستند.






