در زمان ما، فیزیک به یک علم بسیار رایج تبدیل شده است. به معنای واقعی کلمه در همه جا حضور دارد. ابتدایی ترین مثال: درخت سیبی در حیاط شما رشد می کند و میوه ها روی آن می رسند، زمان می رسد و سیب ها شروع به ریزش می کنند، اما به کدام سمت می ریزند؟ به لطف قانون جاذبه جهانی، جنین ما روی زمین می افتد، یعنی پایین می رود، اما نه بالا. این یکی از معروف ترین نمونه های فیزیک بود، اما بیایید به ترمودینامیک یا دقیق تر به تعادل فاز توجه کنیم، که در زندگی ما کم اهمیت نیستند.
ترمودینامیک

اول از همه، بیایید به این اصطلاح نگاه کنیم. ΘερΜοδυναΜική - این کلمه در یونانی اینگونه به نظر می رسد. قسمت اول ΘερΜo به معنای گرما و قسمت دوم δυναΜική به معنای قدرت است. ترمودینامیک شاخه ای از فیزیک است که به بررسی خواص یک سیستم ماکروسکوپی و همچنین روش های مختلف تبدیل و انتقال انرژی می پردازد. در این بخش، حالت ها و فرآیندهای مختلف به طور ویژه مورد بررسی قرار می گیرند تا مفهوم دما را بتوان در توضیحات معرفی کرد (این یک کمیت فیزیکی است که یک سیستم ترمودینامیکی را مشخص می کند و با استفاده از آن اندازه گیری می شود.وسایل خاص). تمام فرآیندهای در حال انجام در سیستمهای ترمودینامیکی فقط با مقادیر میکروسکوپی (فشار و دما و همچنین غلظت اجزا) توصیف میشوند.
معادله کلاپیرون-کلوزیوس
هر فیزیکدانی این معادله را می داند، اما بیایید آن را قطعه قطعه کنیم. به فرآیندهای تعادلی انتقال ماده معین از یک فاز به فاز دیگر اشاره دارد. این به وضوح در چنین نمونه هایی دیده می شود: ذوب، تبخیر، تصعید (یکی از راه های حفظ محصولات که با حذف کامل رطوبت صورت می گیرد). فرمول به وضوح فرآیندهای در حال انجام را نشان می دهد:
- n=PV/RT;
- جایی که T دمای ماده است؛
- P-pressure;
- گرمای خاص انتقال فاز R;
- V-تغییر در حجم خاص.
تاریخچه ایجاد معادله

معادله کلازیوس-کلاپیرون یک توضیح ریاضی عالی از قانون دوم ترمودینامیک است. همچنین به عنوان "نابرابری کلازیوس" نامیده می شود. به طور طبیعی، این قضیه توسط خود دانشمند توسعه داده شد که می خواست رابطه بین جریان گرما در سیستم و آنتروپی و همچنین محیط آن را توضیح دهد. این معادله توسط کلازیوس در تلاش هایش برای توضیح و کمی سازی آنتروپی ایجاد شد. در معنای تحت اللفظی، قضیه این فرصت را به ما می دهد تا تعیین کنیم که آیا یک فرآیند چرخه ای برگشت پذیر است یا غیر قابل برگشت. این نابرابری یک فرمول کمی برای درک قانون دوم به ما ارائه می دهد.
دانشمند یکی از اولین کسانی بود که روی ایده آنتروپی کار کرد و حتی آن را ارائه داد.نام فرآیند آنچه اکنون به عنوان قضیه کلازیوس شناخته می شود، اولین بار در سال 1862 در ششمین اثر رودولف، در مورد استفاده از قضیه هم ارزی تبدیل برای کارهای داخلی منتشر شد. این دانشمند سعی کرد با گرم کردن (δ Q) در سیستم، رابطه ای متناسب بین آنتروپی و جریان انرژی نشان دهد. در ساخت و ساز، این انرژی حرارتی می تواند به کار تبدیل شود و از طریق یک فرآیند چرخه ای به گرما تبدیل شود. رودولف ثابت کرد که «مجموع جبری همه تبدیلهایی که در یک فرآیند چرخهای رخ میدهند، تنها میتواند کمتر از صفر یا در موارد شدید، برابر با صفر باشد.»
سیستم ایزوله بسته
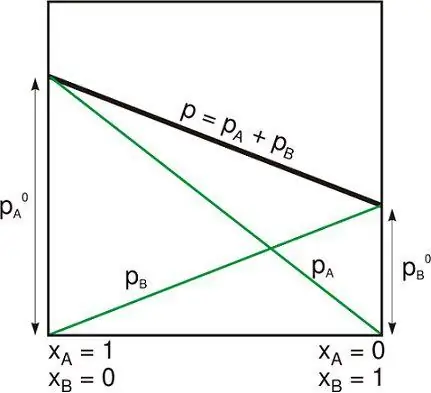
سیستم ایزوله یکی از موارد زیر است:
- سیستم فیزیکی از دیگرانی که با آنها تعاملی ندارند دور است.
- سیستم ترمودینامیکی توسط دیوارهای غیرقابل حرکت سفت و سختی بسته شده است که نه ماده و نه انرژی نمی توانند از آن عبور کنند.
علیرغم این واقعیت که سوژه از نظر درونی با گرانش خود مرتبط است، یک سیستم ایزوله معمولاً فراتر از محدودیت های گرانشی خارجی و سایر نیروهای دور گرفته می شود.
این را می توان با آنچه (در اصطلاح عمومی تر مورد استفاده در ترمودینامیک) سیستم بسته احاطه شده توسط دیوارهای انتخابی که از طریق آنها انرژی به شکل گرما یا کار منتقل می شود، اما نه ماده، نامیده می شود، مقایسه کرد. و با یک سیستم باز که در آن ماده و انرژی وارد یا خارج می شود، اگرچه ممکن است دیوارهای غیر قابل نفوذ مختلفی در آن وجود داشته باشد.بخش هایی از مرزهای آن.
یک سیستم ایزوله از قانون حفاظت پیروی می کند. اغلب در ترمودینامیک، ماده و انرژی به عنوان مفاهیم جداگانه در نظر گرفته می شوند.
انتقالات ترمودینامیکی
برای درک انتقال فاز کوانتومی، مقایسه آنها با تبدیل های کلاسیک (که وارونگی حرارتی نیز نامیده می شود) مفید است. CPT کاسپ در خواص ترمودینامیکی یک سیستم را توصیف می کند. این نشانه سازماندهی مجدد ذرات است. یک مثال معمولی انتقال انجماد آب است که انتقال صاف بین مایع و جامد را توصیف می کند. رشد فاز کلاسیک به دلیل رقابت بین انرژی سیستم و آنتروپی نوسانات حرارتی آن است.
یک سیستم کلاسیک در دمای صفر آنتروپی ندارد و بنابراین هیچ تبدیل فازی نمی تواند رخ دهد. ترتیب آنها توسط اولین پتانسیل ترمودینامیکی مشتق ناپیوسته تعیین می شود. و البته مرتبه اول را دارد. تبدیل فاز از فرومغناطیس به پارامغناطیس پیوسته و مرتبه دوم است. این تغییرات ثابت از یک فاز منظم به یک فاز بی نظم با یک پارامتر مرتبه که صفر است توصیف می شود. برای تبدیل فرومغناطیسی فوق، پارامتر ترتیب، مغناطش کل سیستم خواهد بود.
پتانسیل گیبس
انرژی آزاد گیبس حداکثر مقدار کار بدون انبساط است که می توان از یک سیستم بسته ترمودینامیکی (که می تواند گرما را مبادله کند و با محیط کار کند) حذف شود. چنینحداکثر نتیجه را می توان تنها در یک فرآیند کاملا برگشت پذیر به دست آورد. هنگامی که سیستم از حالت اول به حالت دوم تبدیل می شود، کاهش انرژی آزاد گیبس برابر است با آنچه سیستم در محیط خود انجام می دهد، منهای کار نیروهای فشار.
وضعیت تعادل

تعادل ترمودینامیکی و مکانیکی یک مفهوم بدیهی از ترمودینامیک است. این حالت داخلی یک یا چند سیستم است که توسط دیواره های کم و بیش نفوذپذیر یا غیر قابل نفوذ به هم متصل شده اند. در این حالت، هیچ جریان ماکروسکوپی خالص ماده یا انرژی، چه در یک سیستم و چه بین سیستم ها وجود ندارد.
در تصور خود از وضعیت تعادل داخلی، تغییر ماکروسکوپی رخ نمی دهد. سیستم ها به طور همزمان در تعادل حرارتی، مکانیکی، شیمیایی (ثابت)، تشعشعی متقابل هستند. ممکن است به همین شکل باشند. در این فرآیند، تمام نماها به یکباره و به طور نامحدود ذخیره می شوند تا زمانی که عملیات فیزیکی شکسته شود. در تعادل ماکروسکوپی، مبادلات متعادل کاملاً دقیق انجام می شود. اثبات بالا توضیح فیزیکی این مفهوم است.
اصول
هر قانون، قضایا، فرمول ها مبانی خاص خود را دارند. بیایید به 3 پایه قانون تعادل فاز نگاه کنیم.
- فازشکلی از ماده است که از نظر ترکیب شیمیایی، حالت فیزیکی و تعادل مکانیکی همگن است. فازهای معمولی جامد، مایع و گاز هستند.دو مایع غیر قابل اختلاط (یا مخلوط مایع با ترکیبات مختلف) که با یک مرز جداگانه از هم جدا شده اند، دو فاز مجزا و جامدات غیر قابل اختلاط در نظر گرفته می شوند.
- تعداد اجزاء (C) تعداد اجزاء مستقل شیمیایی سیستم است. حداقل تعداد گونه های مستقل مورد نیاز برای تعیین ترکیب تمام مراحل سیستم.
- تعداد درجات آزادی (F) در این زمینه تعداد متغیرهای فشرده است که مستقل از یکدیگر هستند.
طبقه بندی بر اساس تعادل فاز
- واکنشهای انتقال خالص پیوسته (که اغلب واکنشهای حالت جامد نامیده میشوند) بین مواد جامد با ترکیبهای مختلف رخ میدهند. آنها ممکن است شامل عناصر موجود در مایعات (H, C) باشند، اما این عناصر در فازهای جامد باقی می مانند، بنابراین هیچ فاز مایع به عنوان واکنش دهنده یا محصول درگیر نمی شود (H2O، CO2). واکنشهای انتقال خالص جامد میتواند پیوسته یا ناپیوسته یا پایانی باشد.
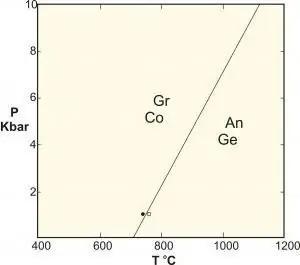
- Polymorphic نوع خاصی از واکنش فاز جامد است که شامل فازهایی با ترکیب یکسان است. نمونههای کلاسیک واکنشهای بین سیلیکاتهای آلومینیوم کیانیت-سیلیمانیت-آندالوزیت، تبدیل گرافیت به الماس در فشار بالا و تعادل کربنات کلسیم است.
قوانین تعادل

قانون کارخانه گیبس توسط جوزیا ویلارد گیبز در مقاله معروف خود با عنوان "تعادل مواد ناهمگن" که از سال 1875 تا 1878 منتشر شد، پیشنهاد شد. اعمال می شودسیستم های ناهمگن چند جزئی غیر واکنشی در تعادل ترمودینامیکی و برابری داده شده است:
- F=C-P+2;
- که در آن F تعداد درجات آزادی است؛
- C – تعداد اجزا؛
- P - تعداد فازهای موجود در تعادل ترمودینامیکی با یکدیگر.
تعداد درجات آزادی تعداد متغیرهای فشرده اشغال نشده است. بیشترین تعداد پارامترهای ترمودینامیکی، مانند دما یا فشار، که می توانند به طور همزمان و خودسرانه بدون تأثیر بر یکدیگر تغییر کنند. نمونه ای از یک سیستم یک جزئی سیستمی با یک ماده شیمیایی خالص است، در حالی که سیستم های دو جزئی مانند مخلوط آب و اتانول دارای دو جزء مستقل هستند. انتقال فاز معمولی (تعادل فاز) جامد، مایع، گاز است.
قانون فاز در فشار ثابت
برای کاربردهایی در علم مواد که با تغییرات فاز بین ساختارهای جامد مختلف سروکار دارند، یک فشار ثابت اغلب رخ می دهد (مثلاً یک اتمسفر) و به عنوان درجه آزادی نادیده گرفته می شود، بنابراین قانون به این صورت می شود: F=C - P + 1.
این فرمول گاهی اوقات با نام "قاعده فاز متراکم" معرفی می شود، اما همانطور که می دانیم برای سیستم هایی که تحت فشارهای بالا هستند (مثلاً در زمین شناسی) قابل استفاده نیست زیرا پیامدهای این فشارها می تواند عواقب فاجعه باری ایجاد کند.
ممکن است به نظر برسد که تعادل فاز فقط یک عبارت خالی است و فرآیندهای فیزیکی کمی وجود دارد که در این لحظهدرگیر است، اما، همانطور که دیدیم، بدون آن، بسیاری از قوانینی که می دانیم کار نمی کنند، بنابراین باید کمی با این قوانین منحصر به فرد، رنگارنگ، هرچند کمی خسته کننده آشنا شوید. این دانش به افراد زیادی کمک کرده است. آنها یاد گرفتند که چگونه آنها را برای خود اعمال کنند، به عنوان مثال، برقکارها، با دانستن قوانین کار با فازها، می توانند از خود در برابر خطرات غیر ضروری محافظت کنند.






